Prof. Dr. med. Petros Christopoulos | |
Wissenschaftskoordination Thoraxonkologie | |
Thoraxklinik am Universitätsklinikum Heidelberg | |
Kurzprofil
Petros Christopoulos ist Professor an der Medizinischen Fakultät der Universität Heidelberg und verantwortet die Wissenschaftskoordination der Thoraxonkologie in der Thoraxklinik am Universitätsklinikum Heidelberg, inkl. Zuständigkeit für die translationale Forschung, das wöchentliche molekulare Tumorboard thorakaler Neoplasien sowie die anschließende Behandlung mit neuen Medikamenten off-label oder im Rahmen von Expanded Access Programmen. Nach dem Medizinstudium in Athen promovierte er an der Medizinischen Fakultät Freiburg und schloß seine Weiterbildung in Innerer Medizin, Notfallmedizin, Hämatologie, Stammzelltransplantation, Medizinischer Onkologie, Palliativmedizin und fachgebundener genetischer Beratung an den Universitätskliniken Freiburg und Würzburg ab. Während dieser Zeit hat auch er an mehreren Phase I/II/III klinischen Studien mitgewirkt und state-of-the-art Methoden der zelullären und molekularen Immunologie für die Charakterisierung vom T‑Zell-Status bei verschiedenen Malignomen angewandt. Seit 2015 ist er in Heidelberg tätig, wo er sich 2019 im Fach Innere Medizin habilitierte.
Expertise
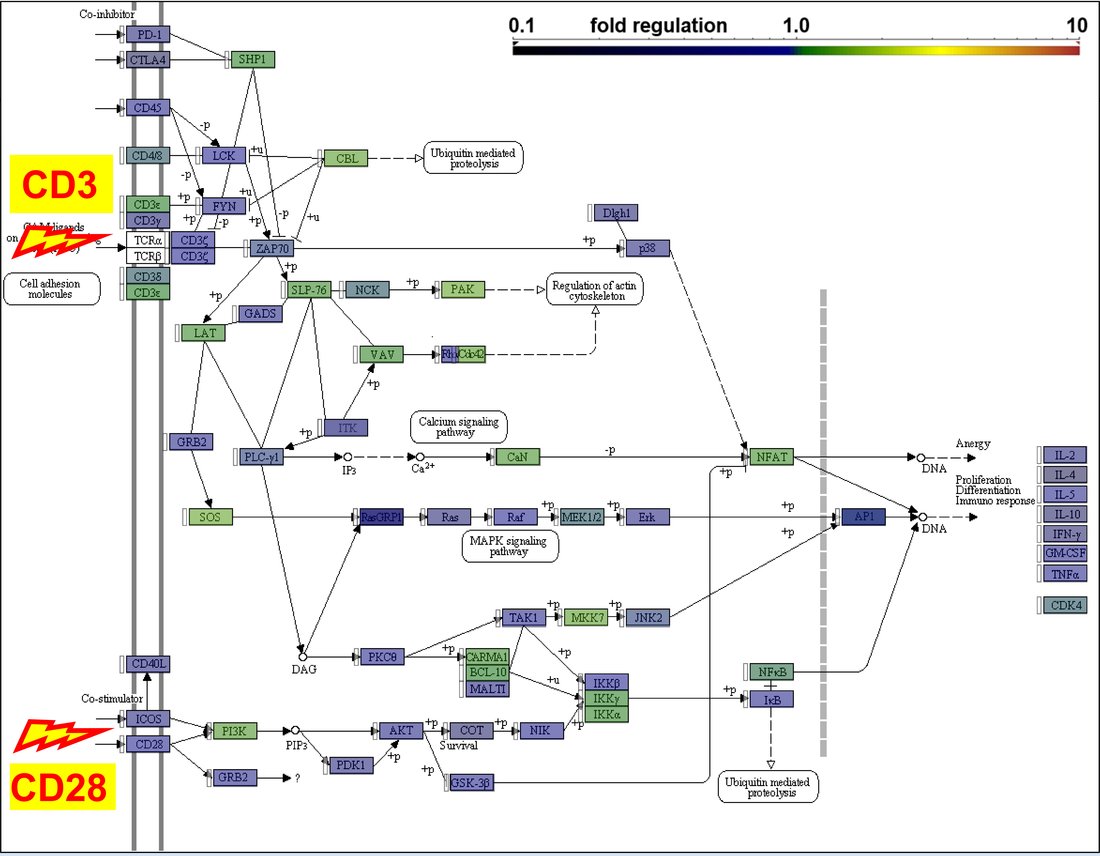
Einen ersten Schwerpunkt bilden die systematische Kohortenexploration und Integration von klinischen mit genetischen, pathologischen, immunologischen und radiologischen Daten. Ziel ist eine verbesserte Patientenstratifikation und Krankheitsüberwachung durch die Identifizierung von neuen Biomarkern und möglichen Therapiezielstrukturen. Die Grundmethodik wurde in Zusammenarbeit mit der Pathologie, Radiologie und dem DKFZ im Rahmen des DZL 2.0 Clinical Flagship Projects "Tackling therapy resistance in ALK+ NSCLC" erfolgreich etabliert und anschließend deutschlandweit im Rahmen der laufenden multizentrischen Phase 2 ABP Studie (NCT04318938) zur Optimierung der Patientenbehandlung basierend auf molekularen Tumoreigenschaften verfolgt. Weitere Patientenkollektive, wie z.B. das immuntherapierte NSCLC, oder Lungenmalignome mit EGFR exon20 Insertionen, werden aktuell ähnlich analysiert. Ein zweiter Fokus ist die Charakterisierung der systemischen Immundysregulation bei Patienten mit thorakalen Tumoren. Multi-Farben-Durchflußzytometrie, Genexpressionsanalysen, TCR-Profiling, proteomische Untersuchungen und T-Zell-Funktionsassays werden jeweils etabliert und kombiniert, um die Tumorimmunologie, Wirkmechanismen unserer Immuntherapeutika, und Pathogenese von Immunnebenwirkungen in der Thoraxonkologie besser zu verstehen. Ein wichtiges Subprojekt adressiert die Thymom-assoziierte Immundefizienz.
- Molekulare Thoraxonkologie
- Charakterisierung der systemischen Immundysregulation bei Patienten mit thorakalen Tumoren
- Immundefizienz bei Thymomen
Lungenkrebs
- The impact of TP53 co-mutations and immunologic microenvironment on outcome of lung cancer with EGFR exon 20 insertions. Christopoulos P, Kluck K, Kirchner M, Lüders H, Roeper J, Falkenstern-Ge R, Szewczyk M, Sticht F, Saalfeld F, Wesseler C, Hackanson B, Dintner S, Faehling M, Kuon J, Janning M, Kauffmann D, Kazdal D, Kurz S, Eichhorn F, Bozorgmehr F, Shah R, Tufman A, Wermke M, Loges S, Brückl W, Schulz C, Misch D, Frost N, Kollemeier J, Reck M, Griesinger F, Grohe C, Liern-Hong J, Lin M, Budczies J, Stenzinger A, Thomas M. Eur J Cancer 2022 May 19;170:106-118. doi: 10.1016/j.ejca.2022.04.020.
- Longitudinal therapy monitoring of ALK-positive lung cancer by combined copy number and targeted mutation profiling of cell-free DNA. Dietz S,* Christopoulos P,* Yuan Z, Angeles AK, Gu L, Volckmar AL, Ogrodnik S, Janke F, Fratte CD, Zemojtel T, Schneider MA, Kazdal D, Endris V, Meister M, Muley T, Cecchin E, Reck M, Schlesner M, Thomas M, Stenzinger A, Sültmann S. EBioMedicine 2020 Dec;62:103103. doi: 10.1016/j.ebiom.2020.103103.
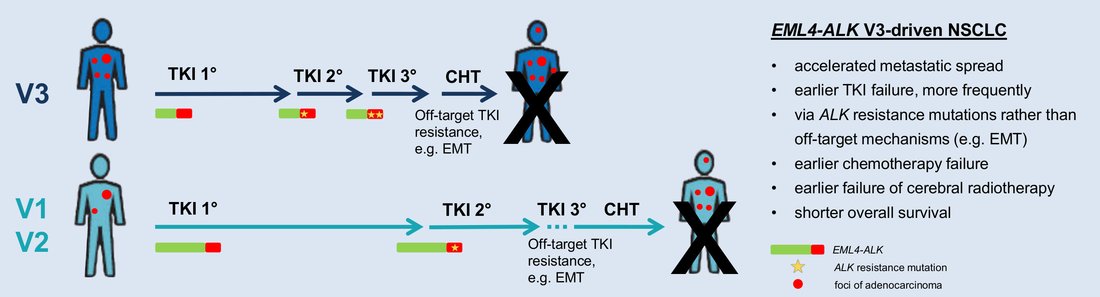
- Identification of a highly lethal V3+TP53+ subset in ALK+ lung adenocarcinoma. Christopoulos P, Kirchner M, Bozorgmehr F, Endris V, Elsayed M, Budczies J, Ristau J, Penzel R, Herth FJ, Heussel CP, Eichhorn M, Muley T, Meister M, Fischer J, Rieken S, Lasitschka F, Bischoff H, Sotillo R, Schirmacher P, Thomas M, Stenzinger A. Int J Cancer 2019 Jan 1;144(1):190-199. doi: 10.1002/ijc.31893 .
- Large cell neuroendocrine lung carcinoma induces peripheral T-cell repertoire alterations with predictive and prognostic significance. Christopoulos P, Schneider MA, Bozorgmehr F, Kuon J, Engel-Riedel W, Kollmeier J, Baum V, Muley T, Schnabel PA, Bischoff H, Grohé C, Serke M, Thomas M, Fisch P, Meister M. Lung Cancer 2018 May;119:48-55. doi: 10.1016/j.lungcan.2018.03.00.
- A novel thymoma-associated immunodeficiency with increased naive T cells and reduced CD247 expression. Christopoulos P, Dopfer EP, Malkovsky M, Esser PR, Schaefer HE, Marx A, Kock S, Rupp N, Lorenz MR, Schwarz K, Harder J, Martin SF, Werner M, Bogdan C, Schamel WA, Fisch P. J Immunol. 2015 Apr 1;194(7):3045-53. doi: 10.4049/jimmunol.1402805 .
- Definition and characterization of the systemic T-cell dysregulation in untreated indolent B-cell lymphoma and very early CLL. Christopoulos P, Pfeifer D, Bartholomé K, Follo M, Timmer J, Fisch P, Veelken H. Blood 2011 Apr 7;117(14):3836-46. doi: 10.1182/blood-2010-07-299321
Lena Gaissmaier | Doktorandin | ||
Mariam Elshiaty | Doktorandin | ||
Hannah Schindler | Doktorandin | ||
Fabienne Lusky | Doktorandin | ||
Tamara Hedinger | Technische Assistentin | ||
Silke Winter | Technische Assistentin |
Lungenforschung - Projekte
- Molekulare Risikostratifizierung bei ALK+ und anderen NSCLC
Nach Charakterisierung der Rolle von ALK Fusionsvarianten und TP53 Komutationen in der Klinik und Biologie des ALK+ NSCLC im Rahmen von früheren Projekten - in enger Zusammenarbeit mit der Pathologie und dem DKFZ - wird jetzt die Wichtigkeit von weiteren molekularen Eigenschaften inkl. Genexpression, Methylierung sowie der immunologischen Tumormikroumgebung für die Resistenzentstehung und das Patientenüberleben systematisch analysiert. Des Weiteren werden analog das EGFR+ und das immuntherapierte NSCLC aufgearbeitet. Die Ergebnisse dienen anschließend in Kooperation mit dem DKFZ zur Entwicklung von neuen Methoden für das molekulare Krankheitsmonitoring und zur Verbesserung der präklinischen Krankheitsmodele. - Charakterisierung der systemischen Immundysregulation bei Patienten mit thorakalen Tumoren
Patientenproben werden longitudinal gesammelt und mit verschiedenen, dynamisch angepaßten Methoden (Multi-Farben-Durchflußzytometrie, Genexpressions- und TCR-Profiling, Proteom- und T-Zell-Funktionsassays) analysiert. Die Identifizierung und Charakterisierung von subklinischen Immundefekten bei Patienten mit NSCLC und anderen thorakalen Tumoren ist von entscheidender Bedeutung für die Steuerung der Immuntherapie und für die Entwicklung von neuen Therapieansätzen. - Thymom-assoziierte Immundefizienz
Die im Rahmen von früheren Projekten identifizierte CD247-assoziierte Immundefizienz bei kortikalen Thymomen wird weiter molekular charakterisiert und im Zusammenhang mit anderen klinischen und immunologischen Parametern analysiert.